南京ANDAeCTD發布系統
歐盟eCTD的遞交途徑與技術要求不同審評程序對應不同遞交渠道:集中程序(CP)通過EMA的eSubmissionGateway或WebClient提交,分散程序(DCP)和互認程序(MRP)則需使用歐盟通用提交門戶(CESP)。文件結構需嚴格遵循模塊化要求,例如CEP申請需包含模塊1(行政文件)、模塊2(質量概述)和模塊3(技術文檔),且XML主干文件須符合EDQM的特定命名規則。此外,所有PDF文件需無密碼保護、可全文檢索,并嵌入層級書簽以支持快su審閱。CEP申請的eCTD遞交特殊性CEP程序自2018年起強zhi采用eCTD格式,重點評估原料yao是否符合歐洲yao典標準。其模塊1需包含EDQM申請表、簡歷及變更說明表,模塊2需使用EDQM提供的質量概述模板,模塊3則按CTD格式組zhi。CEP與ASMF(活性物質主文件)的主要區別在于性:CEP無需關聯上市許可,且審評由EDQM完成。瑞士eCTD驗證標準相關技術支持。南京ANDAeCTD發布系統
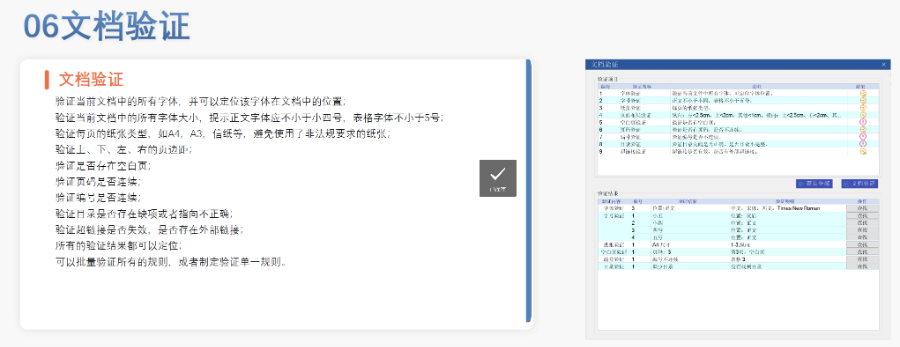
美國eCTD驗證采用三級分類:“錯誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護屬于“錯誤”,而書簽路徑非相對性則可能列為“警告”。驗證失敗將直接導致退審,企業需通過LORENZ Validator等工具預檢,確保提交前合規。 技術驗證點 驗證涵蓋XML結構合規性、文件命名規則、生命周期管理(如序列號連續性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗數據需額外滿足CDISC標準,包括SDTM和ADaM數據集的結構驗證杭州CDE eCTD服務放心可靠澳大利亞的eCTD申報相關技術支持。
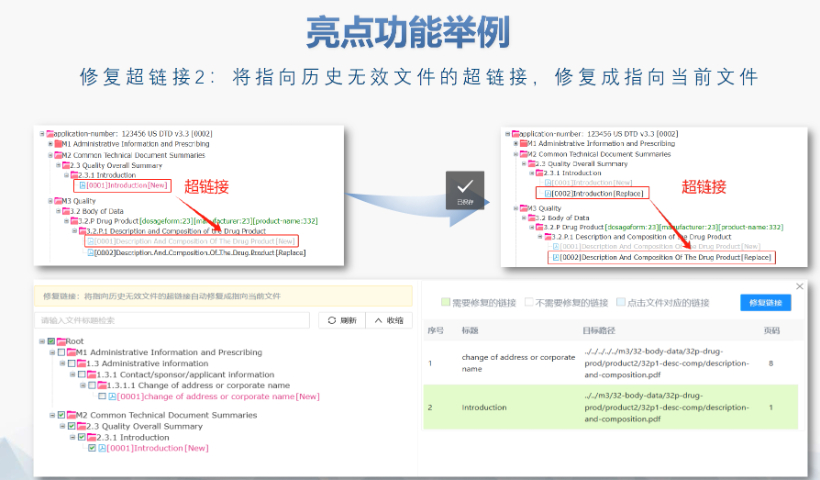
電子簽章與傳輸安全文件需經AES-256加密后刻錄至不可擦寫光盤,并附MD5校驗碼。光盤損壞或bing毒污染將觸發重遞交流程,原載體按銷毀程序處理。審評與核查協同自2018年起,FDA要求提交兩套光盤分別用于審評和現場核查,2022年調整為“1套審評+1套核查+1套專項資料”模式,提升流程效率。guo際化兼容性增強美國eCTD系統支持與歐盟、日本等地區的XML互操作性,但區域差異(如模塊1的標簽要求)仍需人工適配。未來通道創FDA計劃引入API接口支持企業系統直連,并探索基于云存儲的實時提交與審評,減少物理媒介依賴。
eCTD的技術架構與模塊要求:美國eCTD基于XML技術,嚴格遵循ICHM4框架,分為5個模塊:模塊1(地區行政信息)、模塊2(技術總結)、模塊3-5(質量、非臨床與臨床數據)。其中,模塊1需包含FDA特定的,涵蓋申請編號、聯系人和DMF授權書等行政信息。模塊2-5需與ICHCTD全球統一標準一致,但FDA對文件顆粒度要求更細,例如非臨床研究報告需拆分并標記StudyID。PDF文件需符合FDA,包括字體嵌入、書簽層級和超鏈接功能。eCTD的技術架構與模塊要求:美國eCTD基于XML技術,嚴格遵循ICHM4框架,分為5個模塊:模塊1(地區行政信息)、模塊2(技術總結)、模塊3-5(質量、非臨床與臨床數據)。其中,模塊1需包含FDA特定的,涵蓋申請編號、聯系人和DMF授權書等行政信息。模塊2-5需與ICHCTD全球統一標準一致,但FDA對文件顆粒度要求更細,例如非臨床研究報告需拆分并標記StudyID。PDF文件需符合FDA,包括字體嵌入、書簽層級和超鏈接功能。 美國ANDA注冊申報相關技術支持。
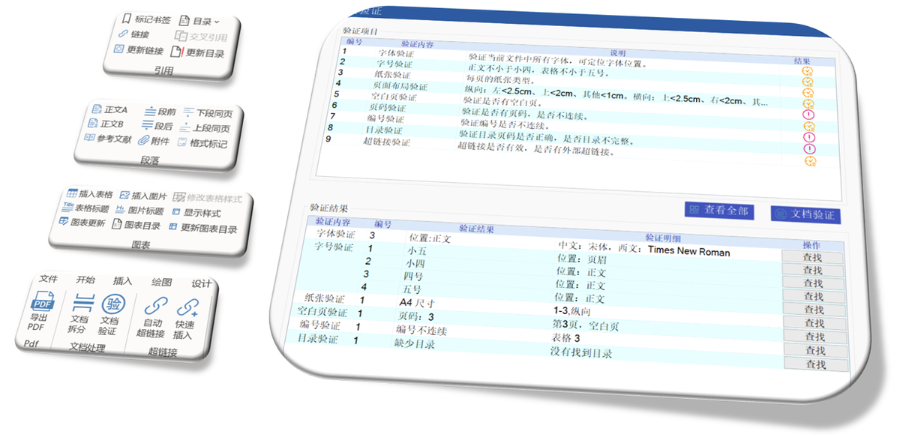
《ZHONG國eCTD驗證實踐手冊》作為2025年2月發布的技術指南(發布日期見),為YAO品注冊申請人提供了系統化的eCTD申報驗證操作指引。該手冊基于《ZHONOG國eCTD驗證標準》的框架,重點覆蓋驗證流程中的六大關鍵領域:基礎識別、文件/文件夾規范、ICH骨架文件完整性、區域性管理信息校驗、研究標簽文件(STF)邏輯性及PDF技術合規性。手冊特別強調對"錯誤警告提示"三級驗證結果的差異化處理策略,指導申請人通過賦悅eCTD軟件進行元數據填報、STF節點配置及擴展節點合規性檢查,同時針對ZHONG國特有的注冊類型差異提出模塊化申報資料準備方案。對于PDF文檔,手冊細化到書簽路徑、超鏈接屬性及字體嵌入等技術細節,確保電子資料符合CDE審評系統的解析要求。此外,手冊還結合SHENG物制品與化學YAO品的申報差異,明確了,并通過案例解析說明函與申請表生命周期的管理規則。 歐盟NDA注冊申報相關技術支持。高新區ANDAeCTD服務電話
歐盟ANDA注冊申報相關技術支持。南京ANDAeCTD發布系統
美國eCTD的強制實施時間與范圍:美國自2017年5月5日起要求申請(NDA)、仿制yao申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,2018年5月5日進一步擴展至臨床試驗申請(IND)和yao品主文件(DMF)。FDA通過《聯邦食品、yao品和化妝品法案》第745A條明確電子提交的強制性,豁免非商業化IND和部分DMF類型(如Ⅲ類)。2023年數據顯示,FDA接收的eCTD申請占比已達92%,標志著電子化審評體系的成熟。企業若未按規范提交(如缺少文件或重復序列號),將直接被拒收。南京ANDAeCTD發布系統
- 楊浦區eCTD品牌 2025-12-20
- 河北仿制藥eCTD 2025-12-20
- 合肥NDAeCTD品牌 2025-12-20
- 吉林國際注冊eCTD 2025-12-20
- 無錫賦悅科技eCTD找哪家 2025-12-20
- 楊浦區國際注冊eCTD醫療科技 2025-12-20
- 徐匯區中國eCTD報價 2025-12-20
- 蘇州新藥eCTD 2025-12-20
- 北京加拿大eCTD 2025-12-20
- 靜安區CDE eCTD品牌 2025-12-20
- 鎮江怎樣智慧醫療設計 2025-12-21
- 全椒社交媒體網站搭建標準 2025-12-21
- 北京云飛云科技云服務器注意事項 2025-12-21
- 遼寧達寬科技力控系統報價 2025-12-21
- 泰州社交APP聯系方式 2025-12-21
- 推薦的數字孿生與CIM平臺市場價格 2025-12-21
- 四川多模態搜索結果協同的GEO生成引擎優化平臺 2025-12-21
- 上海自動化TFT 2025-12-21
- 四川創意內容抖音代運營服務方案 2025-12-21
- 初中物理實驗教學平臺排名 2025-12-21