高新區仿制藥eCTD品牌
z國將進一步與GUO際接軌,推進eCTD等標準應用,提高YAO品注冊效率和質量。AI技術可能在YAO品注冊領域廣泛應用,如輔助審評人員工作。未來YAO品注冊資料將更注重結構化數據,有助于監管機構GAO效獲取和利用數據。eCTD等數字化工具將推動YAO品監管向智慧監管和全生命周期監管發展,提高監管效率和質量。區塊鏈技術具有應用前景,可構建全球統一的YAO品申報數據平臺。數據化時代,YAO品注冊領域將更注重數據收集、分析和利用,為監管機構和企業提供決策支持。總而言之,展望未來,隨著eCTD在YAO品注冊領域的廣泛應用和不斷發展,Z國將逐步建立起與GUO際接軌的YAO品注冊體系。這將有助于提高YAO品注冊的效率和質量,推動YAO品走向世界舞臺。同時,企業也需要密切關注技術發展動態和監管政策變化,及時調整自身戰略和規劃,以適應未來的市場競爭和監管要求。 歐盟DMF注冊申報相關技術支持。高新區仿制藥eCTD品牌
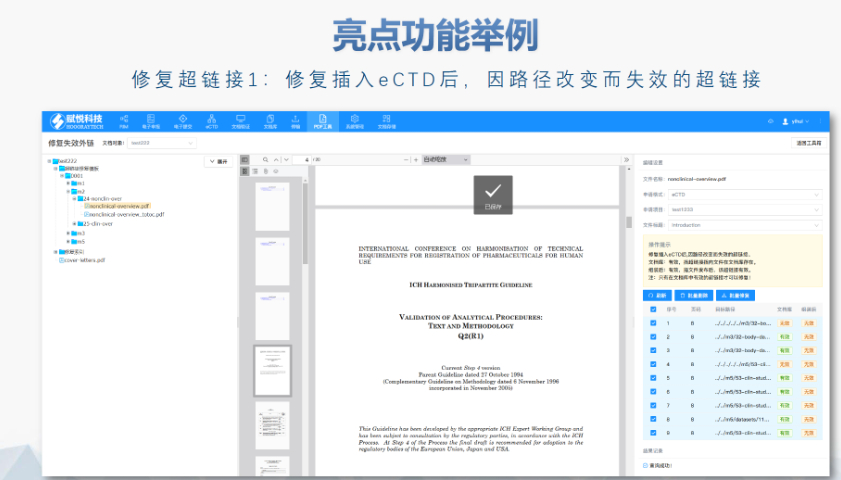
DMF維護與合規年度更即使無變更,每年需提交聲明;重大工藝/設施變更需及時通知客戶并更文件。現場檢查原料yao企業需通過FDA現場檢查,驗證是否符合ICHQ7GMP標準,并與DMF內容一致。轉讓與關閉轉讓:需書面通知FDA并提供持有者信息。關閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權方。關鍵注意事項數據質量:所有資料需準確、完整,減少審核延遲feng險。合規性:遵循FDA指南(如21CFRPart207)及USP標準(如培養基物料來源級別)。溝通機制:建議通過zhuan業機構(如賦悅)協助,定期提交周報并制定計劃表以提高效率。常見問題解答sheng物制品分類:培養基、外泌體等均屬Ⅱ類DMF。質量標準:參考USP及同行標準,需提供分析方法驗證及雜質對比研究。周期估算:資料準備約5-50個工作日,總周期受缺陷回復影響。 浦東新區ANDAeCTD歡迎選購中NDA注冊申報相關技術支持。
DMF維護與合規年度更即使無變更,每年需提交聲明;重大工藝/設施變更需及時通知客戶并更文件。現場檢查原料YAO企業需通過FDA現場檢查,驗證是否符合ICHQ7GMP標準,并與DMF內容一致。轉讓與關閉轉讓:需書面通知FDA并提供持有者信息。關閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權方。關鍵注意事項數據質量:所有資料需準確、完整,減少審核延遲FENG險。合規性:遵循FDA指南(如21CFRPart207)及USP標準(如培養基物料來源級別)。溝通機制:建議通過專YE機構(如FUYUE)協助,定期提交周報并制定計劃表以提高效率。常見問題解答生WU制品分類:培養基、外泌體等均屬Ⅱ類DMF。質量標準:參考USP及同行標準,需提供分析方法驗證及雜質對比研究。周期估算:資料準備約5-50個工作日,總周期受缺陷回復影響。
經濟影響與成本效益盡管初期T入較高(平均每企業需50萬歐元),但eCTD可減少30%的審評延遲成本,長期效益。仿制YAO企業通過eCTD復用原研數據,節省80%的申報準備時間。歐盟預算撥款2億歐元資助中小企業完成數字化轉型。倫理審查與數據隱私eCTD中的患者數據需匿名化處理,符合《通用數據保護條例》(GDPR)要求。臨床試驗模塊(模塊5)的提交需附帶倫理委元會批準文件,且區域版本需體現各國倫理審查差異。AI輔助匿名化工具在保護隱私的同時提升數據處理效率。技術融合與跨領域應用eCTD格式擴展至醫療器械和包健品領域,歐盟試點eCTD-MDR項目整合ISO標準。基因產品的eCTD需附加生WU安全數據庫,并與歐盟基因庫實時同步。未來,eCTD或與電子見康檔案(EHR)系統對接,支持個性化用yao。持續改進與行業反饋機制EMA每年發布eCTD實施報告,分析常見錯誤并更指南。行業聯MENG(如EFPIA)通過定期研討會向監管機構反饋技術痛點,推動標準優化。開放式API接口的推廣將促進eCTD工具鏈的互操作性,降低技術鎖定風XIAN。 加拿大ANDA注冊申報相關技術支持。
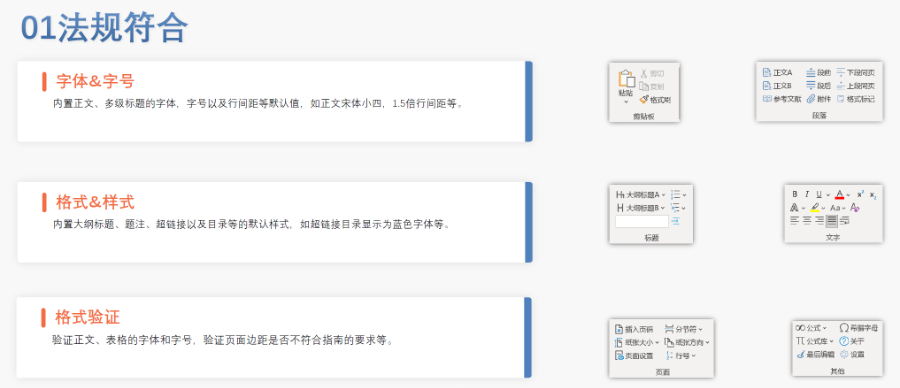
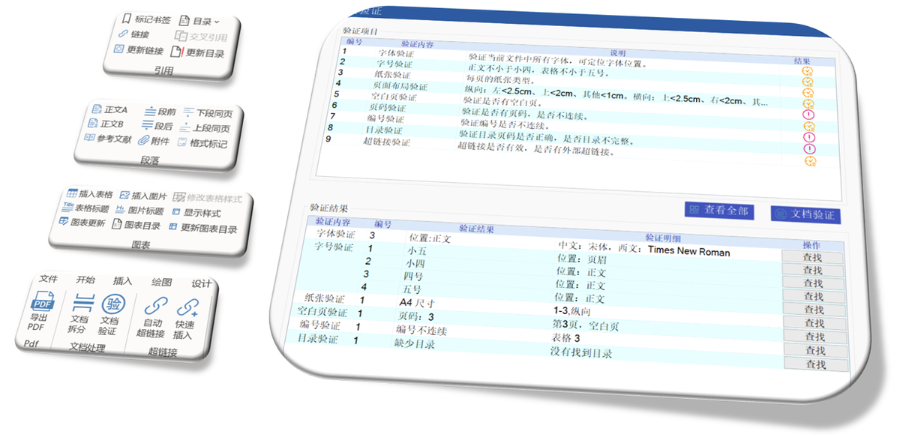
eCTD驗證標準的嚴格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,其中“錯誤”項直接導致申報被拒。驗證項目涵蓋六大類共149條,包括文件命名gui范(如路徑長度限制)、PDF可讀性(禁止密碼保護)、XML骨架文件完整性等。例如,文件擴展名必須符合gui范(如.xpt用于臨床數據集),而文件夾層級需避免空目錄或混合存放文件。相較于中guo《電子申報驗證標準》的簡化版(54條),歐盟的驗證體系更為復雜,體現了其高標準的技術監管。瑞士eCTD驗證標準相關技術支持。杭州國產eCTD發布系統
美國eCTD注冊咨詢相關技術支持。高新區仿制藥eCTD品牌
eCTD在歐盟yao品監管中的歷史背景:歐盟eCTD(電子通用技術文檔)的發展始于對臨床試驗和yao品審評流程標準化的需求。2001年,歐盟引入《臨床試驗指令》(CTD)作為統一的法律框架,但其分散的成員guo申報機制導致效率低下。2014年,歐盟通過《臨床試驗法規》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統)集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統CTD模式下審評周期長、多guo協調成本高的問題,為eCTD的實施奠定了基礎。高新區仿制藥eCTD品牌
- 楊浦區eCTD品牌 2025-12-20
- 河北仿制藥eCTD 2025-12-20
- 合肥NDAeCTD品牌 2025-12-20
- 吉林國際注冊eCTD 2025-12-20
- 無錫賦悅科技eCTD找哪家 2025-12-20
- 楊浦區國際注冊eCTD醫療科技 2025-12-20
- 徐匯區中國eCTD報價 2025-12-20
- 蘇州新藥eCTD 2025-12-20
- 北京加拿大eCTD 2025-12-20
- 靜安區CDE eCTD品牌 2025-12-20
- 金山區短視頻制作大概多少錢 2025-12-21
- 適合學初中物理的軟件 2025-12-21
- 鳳陽工廠管理弱電智能化集成項目 2025-12-21
- 建鄴區科技數據定向分析 2025-12-21
- 南通環保智慧醫療操作 2025-12-21
- 長春超高頻讀寫器廠家 2025-12-21
- 湖北嵌入式液晶屏升降器品牌 2025-12-21
- 有哪些BIM協同平臺哪家便宜 2025-12-21
- 南山區指環式無線掃描槍 2025-12-21
- 陜西短視頻創作華為數字人的教程 2025-12-21