無錫正規外泌體提取試劑廠家供應
人體內多種細胞及體液均可分泌外泌體,包括內皮細胞、免疫細胞、血小板、平滑肌細胞等。當其由宿主細胞被分泌到受體細胞中時,外泌體可通過其攜帶的蛋白質、核酸、脂類等來調節受體細胞的生物學活性。外泌體介導的細胞間通訊主要通過以下三種方式:一是外泌體膜蛋白可以與靶細胞膜蛋白結合,進而靶細胞細胞內的信號通路。二是在細胞外基質中,外泌體膜蛋白可以被蛋白酶剪切,剪切的碎片可以作為配體與細胞膜上的受體結合,從而細胞內的信號通路。有報道稱一些外泌體膜上蛋白在其來源細胞膜上未能檢測出。外泌體提取:免疫分離技術。無錫正規外泌體提取試劑廠家供應

外泌體與神經退行性疾病:外泌體可能促進或限制大腦中未折疊和異常折疊的蛋白質的聚集。AD病人腦脊液外泌體中均可檢測到Tau和Aβ蛋白。類似的現象也在PD和ALS疾病中發現。PD病人腦脊液外泌體可檢測到α-synuclein,ALS病人外泌體中也可以檢測到SOD1或TDP-43。外泌體與疾病診斷(應用潛能):外泌體生成機制表明,通過分析外泌體的組分,可以幫助識別其來源的細胞類型。這一特性已被應用于開發心血管疾病,神經系統疾病和一些病癥的分子診斷方法,也在肝腎肺相關疾病中進行研發測試。將沉淀物用PBS緩沖液進行懸浮,使外泌體懸浮于液體上層蕪湖正規外泌體提取試劑廠家批發價同時對超速離心機的設備要求以及操作程序的培訓較大提高了提取成本。

外泌體的提取方法學規范、統一定量及鑒定等。關于外泌體的提取有超速離心、試劑盒、超濾法、蔗糖密度梯度離心等,然而各種方法均有其利弊。超速離心法是目前外泌體相關文章中的主流方法,由于離心步驟繁瑣,費事費力,而且步驟多導致實驗中容易污染,且損耗量大,使得較終回收的外泌體不穩定。而且對于抽提細胞上清來說,更是極為不請便,試想用提取300ml的上清需要6個50ml離心管,無論是過濾還是后續的每一步的離心去沉淀,都具有操作極其不便的缺點,總之非常麻煩。而超濾法存在外泌體會堵塞膜孔,造成濃縮效率低,濃縮管重復利用差,甚至堵塞在膜孔的外泌體還可能會粘連成團,造成損失及較后的數據有誤差,對于后續實驗也有影響。
1983年,外泌體初次于綿羊網織紅細胞中被發現,1987年Johnstone將其命名為“exosome”。多種細胞在正常及病理狀態下均可分泌外泌體。其主要來源于細胞內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中。所有培養的細胞類型均可分泌外泌體,且外泌體天然存在于體液中,包括血液、唾液、尿液、腦脊液和乳汁中。有關他們分泌和攝取及其組成、“運載物”和相應功能的精確分子機制剛剛開始研究。外泌體目前被視為特異性分泌的膜泡,參與細胞間通訊,對外泌體的研究興趣日益增長,無論是研究其功能還是了解如何將其用于微創診斷的開發。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。
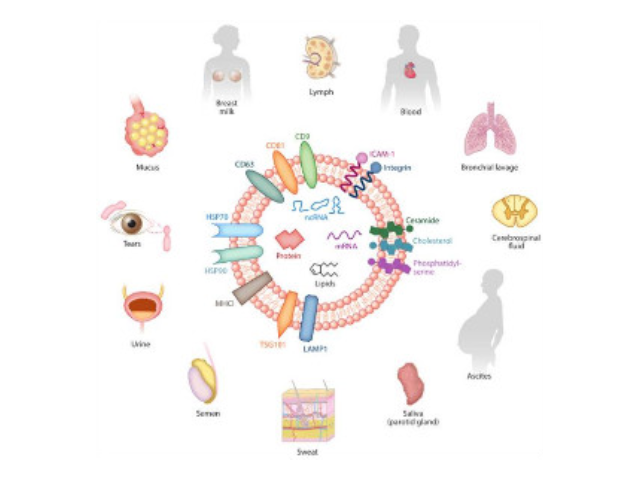
外泌體鑒定:參與生物功能的分子,如凋亡轉接基因2互作蛋白X(ALIX)、一些病癥易感基因101蛋白(TSG101)、熱休克蛋白(HSP70、HSP90),以及細胞分泌的特異性蛋白。外泌體高通量檢測。外泌體內含有與細胞來源相關的蛋白質和核酸,可以運輸蛋白質、mRNA、miRNA、lncRNA、circRNA等進入受體細胞,參與細胞間通訊。不同細胞來源的外泌體所含有的蛋白成分和RNA不太相同,可作為多種疾病的早期診斷標記物,也能作為靶向藥物的載體進行疾病治病。高通量測序。2.mRNA高通量測序。芯片(人、小鼠)。芯片(人、小鼠)。5.蛋白質組分析(iTRAQ、TMT、Label-free)。目前人們多采用超速離心、免疫磁珠、超濾、沉淀或試劑盒等方法實現外泌體的提取分離。太原外泌體提取試劑廠家直銷
在體內細胞間物質和信號轉導中起到重要作用。無錫正規外泌體提取試劑廠家供應
用于外泌體提取的體液收集注意事項:1、選擇血清還是血漿?推薦大多數研究選擇血漿。血液凝固過程中血小板會產生大量外泌體,含量占血清中外泌體的50%以上,選擇血漿可避免不必要的影響。2、注意抗凝劑的選擇。肝素類抗凝劑與PCR假陰性有關,這可能是因為肝素與引物和/或酶有競爭作用。除了克制PCR,肝素可以與外泌體結合,阻止細胞攝取外泌體。因此需要記錄肝素類藥物的患者的血液樣本。EDTA和雙嘧達莫(CTAD),CTAD可以阻止血小板的并克制其釋放外泌體。EDTA可能會干擾PCR反應(盡管其程度小于肝素),但是還是優于其他選擇。此外,有研究表明鈣螯合劑可在體外促進外泌體與血小板的結合從而降低經EDTA、或檸檬酸鹽處理后的血液樣本中外泌體的表觀數量。無錫正規外泌體提取試劑廠家供應
- 深圳RNA提取試劑價格 2025-12-23
- 南昌外泌體提取試劑哪家好 2025-12-23
- 徐州正規外泌體提取試劑服務電話 2025-12-23
- 成都外泌體提取試劑供應商 2025-12-23
- 唐山無血清細胞凍存液生產廠家 2025-12-23
- 南昌外泌體提取試劑廠家現貨 2025-12-23
- 廣州正規原代細胞分離試劑盒供應商 2025-12-23
- 石家莊正規外泌體提取試劑哪家便宜 2025-12-23
- 蘇州無血清細胞凍存液廠家直銷 2025-12-23
- 金華外泌體提取試劑推薦廠家 2025-12-23
- 福建GABA調制乳價位 2025-12-23
- 本地門窗幕墻膠品牌排行榜 2025-12-23
- 來賓附近鍍金專賣 2025-12-23
- 江蘇酸性除銹劑推薦廠家 2025-12-23
- 廣東紡織光亮劑特點 2025-12-23
- 江蘇蒸發器高鹽阻垢劑 2025-12-23
- 黑龍江什么是勻染劑推薦廠家 2025-12-23
- 北京耐候性強乳膠漆翻新方法 2025-12-23
- 地坪防腐涂料質量 2025-12-23
- 重慶耐酸堿腐蝕工程橡膠化工反應釜密封 2025-12-23