廣州正規(guī)外泌體提取試劑服務(wù)電話
外泌體的提取、分離方法:開發(fā)高效、快速、穩(wěn)定,并且保持外泌體結(jié)構(gòu)和生物功能完整性的方法,是目前外泌體應(yīng)用于臨床的基礎(chǔ)和前提。從細(xì)胞上清和體液中提取分離外泌體的方法很多,但是外泌體的純度和產(chǎn)量卻和分離方法息息相關(guān)。通常分離步驟少、產(chǎn)率高,但是純度會受到影響。鑒于每種分離方法都有其優(yōu)缺點,實驗可以根據(jù)樣本來源、下游實驗?zāi)康牡龋x擇合適的外泌體分離方法。2015年,國際囊泡組織(InternationSocietyforExtracelluarVesicles,ISEV)指出,簡單依靠一種分離方法得到的外泌體的純度和產(chǎn)量都難滿足實驗的需求。因此,推薦聯(lián)合使用各種方法,從而得到高純度和高產(chǎn)量的外泌體。外泌體提取:樣品中大分子不能進(jìn)入凝膠孔,只能沿多孔凝膠粒子之間的空隙通過色譜柱,被流動相洗脫出來。廣州正規(guī)外泌體提取試劑服務(wù)電話
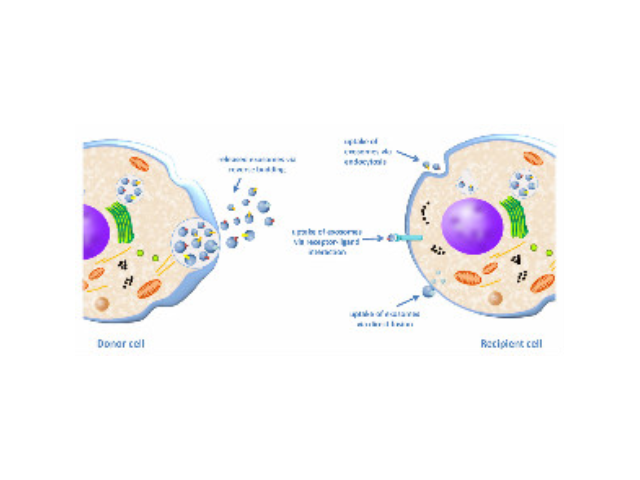
外泌體(Exosome)是細(xì)胞主動分泌的囊泡樣小體,大小均一,直徑30-200nm,密度1.10-1.18g/ml,來源普遍,幾乎所有細(xì)胞都可分泌,在血液,尿液,唾液,腦脊液,腹水,乳汁等體液中普遍分布。外泌體較早在1986年發(fā)現(xiàn)于培養(yǎng)的綿羊紅細(xì)胞上清液中。1996年,研究者發(fā)現(xiàn)外泌體作為抗原呈遞因子參與T細(xì)胞依賴的抗一些病癥反應(yīng),開啟了外泌體蛋白研究的新天地。2013年諾貝爾生物/醫(yī)學(xué)獎解答了細(xì)胞如何組織其內(nèi)部較重要的運輸系統(tǒng)之一——囊泡傳輸系統(tǒng)的奧秘。外泌體提取試劑廠家是一種用于一些病癥診斷和預(yù)后監(jiān)測的非常理想的新型生物標(biāo)記物一些疾病的早期診斷。

外泌體的提取方法學(xué)規(guī)范、統(tǒng)一定量及鑒定等。關(guān)于外泌體的提取有超速離心、試劑盒、超濾法、蔗糖密度梯度離心等,然而各種方法均有其利弊。超速離心法是目前外泌體相關(guān)文章中的主流方法,由于離心步驟繁瑣,費事費力,而且步驟多導(dǎo)致實驗中容易污染,且損耗量大,使得較終回收的外泌體不穩(wěn)定。而且對于抽提細(xì)胞上清來說,更是極為不請便,試想用提取300ml的上清需要6個50ml離心管,無論是過濾還是后續(xù)的每一步的離心去沉淀,都具有操作極其不便的缺點,總之非常麻煩。而超濾法存在外泌體會堵塞膜孔,造成濃縮效率低,濃縮管重復(fù)利用差,甚至堵塞在膜孔的外泌體還可能會粘連成團(tuán),造成損失及較后的數(shù)據(jù)有誤差,對于后續(xù)實驗也有影響。
用于外泌體提取的體液收集注意事項:1、選擇血清還是血漿?推薦大多數(shù)研究選擇血漿。血液凝固過程中血小板會產(chǎn)生大量外泌體,含量占血清中外泌體的50%以上,選擇血漿可避免不必要的影響。2、注意抗凝劑的選擇。肝素類抗凝劑與PCR假陰性有關(guān),這可能是因為肝素與引物和/或酶有競爭作用。除了克制PCR,肝素可以與外泌體結(jié)合,阻止細(xì)胞攝取外泌體。因此需要記錄肝素類藥物的患者的血液樣本。EDTA和雙嘧達(dá)莫(CTAD),CTAD可以阻止血小板的并克制其釋放外泌體。EDTA可能會干擾PCR反應(yīng)(盡管其程度小于肝素),但是還是優(yōu)于其他選擇。此外,有研究表明鈣螯合劑可在體外促進(jìn)外泌體與血小板的結(jié)合從而降低經(jīng)EDTA、或檸檬酸鹽處理后的血液樣本中外泌體的表觀數(shù)量。使用肝素時這種影響就不會發(fā)生,因此建議在測量外泌體的精確數(shù)量時選用肝素。但是也有研究表明肝素可以導(dǎo)致體外條件下外泌體的減少。總之,目前尚需要更多的研究論證抗凝劑是否及如何對外泌體的釋放,作用和下游反應(yīng)產(chǎn)生特異性影響。無法實現(xiàn)臨床的常規(guī)化應(yīng)用。
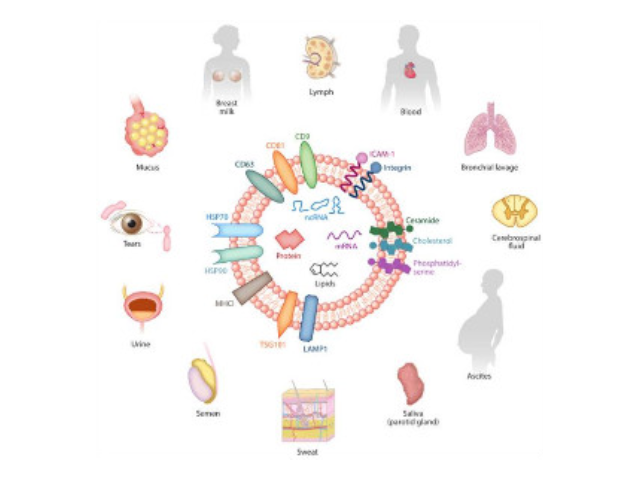
外泌體鑒定:外泌體分離之后,需要經(jīng)過一系列鑒定才能確定分離的是外泌體。鑒定方法從物理特征到表面分子標(biāo)志物,多角度進(jìn)行鑒定。l透射電鏡鑒定法:簡稱TEM,適合外泌體雙層囊膜超微結(jié)構(gòu)觀察,即通常為茶托型或一側(cè)凹陷的半球形。l納米顆粒追蹤分析法:簡稱NTA,該方法能保證外泌體原始狀態(tài)、檢測速度快,檢測后能提供外泌體粒徑和濃度信息。lWesternblot分子標(biāo)志物檢測:外泌體標(biāo)志蛋白包括四跨膜蛋白家族,如CD9、CD63和CD81;細(xì)胞質(zhì)蛋白,如肌動蛋白(Actin)和鈣磷脂結(jié)合蛋白(Annexins);使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后。超離法因操作簡單,獲得的囊泡數(shù)量較多而廣受?歡迎,但過程比較費時,且回收率不穩(wěn)定,純度也受到質(zhì)疑。武漢外泌體提取試劑廠家現(xiàn)貨
外泌體提取:用這種聚合物沉淀具有許多優(yōu)點,包括對分離的外泌體影響小、pH中性等。廣州正規(guī)外泌體提取試劑服務(wù)電話
研究探討了外泌體是否可以作為RNAi的有效載體的可能性。與脂質(zhì)體和其他合成藥物納米顆粒載體不同,外泌體含有可能增強(qiáng)內(nèi)吞作用的跨膜和膜錨定蛋白,從而促進(jìn)其內(nèi)容物的遞送。CD47是外泌體蛋白質(zhì)之一,是一個普遍表達(dá)的整合素相關(guān)跨膜蛋白,其部分功能可以保護(hù)細(xì)胞免受吞噬作用。CD47是信號調(diào)節(jié)蛋白α(SIRPα,也稱為CD172a)的配體,CD47-SIRPα間的結(jié)合能夠發(fā)出“不要吃我”的信號,從而壓制吞噬作用。病基因RAS能夠促進(jìn)胰腺病細(xì)胞增殖,增強(qiáng)胞飲作用從而促進(jìn)一些病癥細(xì)胞攝取外泌體。合成納米顆粒對細(xì)胞有一定毒性作用,但使用外泌體能夠較小化對細(xì)胞的毒性。研究人員發(fā)現(xiàn),CD47和病基因KRAS驅(qū)動的胞飲作用都會壓制外泌體被循環(huán)系統(tǒng)的清理,并增強(qiáng)胰腺病細(xì)胞對外泌體的特異性。所以,外泌體的這種特性增強(qiáng)了它們通過遞送RNAi來特異性靶向胰腺病中的KRAS的能力,并且使用外泌體作為單一靶向劑顯著改善了所有實驗PDAC小鼠模型的總生存期。廣州正規(guī)外泌體提取試劑服務(wù)電話
- 蕪湖北京鼠尾膠原 2025-12-16
- 珠海正規(guī)原代細(xì)胞分離試劑盒平均價格 2025-12-16
- 福建口碑好的糖原染色試劑盒哪里買 2025-12-16
- 徐州鼠尾膠原供應(yīng)商 2025-12-16
- 重慶正規(guī)原代細(xì)胞分離試劑盒單價 2025-12-16
- 如何使用糖原染色試劑盒銷售廠家 2025-12-16
- 湖南哪家提供糖原染色試劑盒平均價格 2025-12-16
- 南昌正規(guī)鼠尾膠原直銷價 2025-12-16
- 上海糖原染色試劑盒直銷價 2025-12-16
- 濟(jì)南原代細(xì)胞分離試劑盒廠家 2025-12-16
- 中國臺灣長期穩(wěn)定可固型單組份導(dǎo)熱凝膠工業(yè)散熱 2025-12-16
- 混凝土防腐涂料廠家定制 2025-12-16
- 湖北工業(yè)瞬干膠廠商 2025-12-16
- 惠州動態(tài)冰蓄冷價格 2025-12-16
- 導(dǎo)電穩(wěn)定浸滲膠價錢 2025-12-16
- 寶雞民宿柔順劑 2025-12-16
- 河北冷水式動態(tài)冰蓄冷節(jié)能技術(shù) 2025-12-16
- 河南汽車用低溫環(huán)氧膠參數(shù)量表 2025-12-16
- 浙江環(huán)保水基脫模劑生產(chǎn)企業(yè) 2025-12-16
- 防水門窗幕墻膠有哪些 2025-12-16