深圳正規外泌體提取試劑推薦廠家
外泌體與肺病預后:外泌體mirRNA和蛋白質被認為是NSCLC的預后因子。Dejima等在研究NSCLC患者預后的生物標志物時發現,外泌體miR-4257和miR-21的含量顯著上升。此外,還有研究表明,低水平miR-146a-5p的NSCLC患者較高水平miR-146a-5p的NSCLC患者有更高的復發率。Sandfeld-Paulsen等在研究276例NSCLC患者血漿的外泌體時發現,NY-ESO-1是其中對低生存率有顯著影響的標志物。Silva等利用TaqMan低密度芯片的方法系統分析了28位NSCLC患者體內的365種miRNA,其中let-7f、miR-30e-3p和miR-20b表達均下調,進一步研究發現,let-7f和miR-30e-3p水平可以區分早期和晚期NSCLC患者,高水平let-7f和miR-30e-3p與不良預后密切相關。外泌體提取:在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層。深圳正規外泌體提取試劑推薦廠家
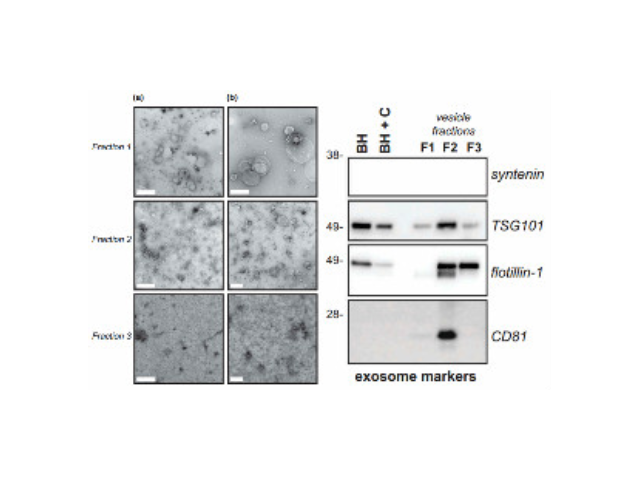
外泌體的提取分離:1、PEG-base沉淀法。聚乙二醇(PEG)可與疏水性蛋白和脂質分子結合共沉淀,早先應用于從血清等樣本中收集病毒,現在也被用來沉淀外泌體,其原理可能與競爭性結合游離水分子有關。利用PEG沉淀外泌體存在不少問題:比如純度和回收率低,雜蛋白較多(假陽性),顆粒大小不均一,產生難以去除的聚合物,機械力或者吐溫-20等化學添加物將會破壞外泌體等,因此發表文章時易受質疑。2、試劑盒提取。近幾年來,市場上已出現各種商業化的外泌體提取試劑盒,有的是通過特殊設計的過濾器過濾掉雜質成分,有的則采用空間排阻色譜法(SEC)進行分離純化,也有的則利用化合物沉淀將法外泌體沉淀出來。這些試劑盒不需要特殊設備,隨著產品不斷更新換代,提取效率和純化效果逐漸提高,因而逐漸取代超速離心法并推廣開來。有些試劑盒操作簡便,不用超速離心,同時可獲得高純度和高回收率的外泌體。深圳正規外泌體提取試劑推薦廠家外泌體提取:通過色譜分離的外泌體不受剪切力的影響,這可能會改變囊泡的結構。
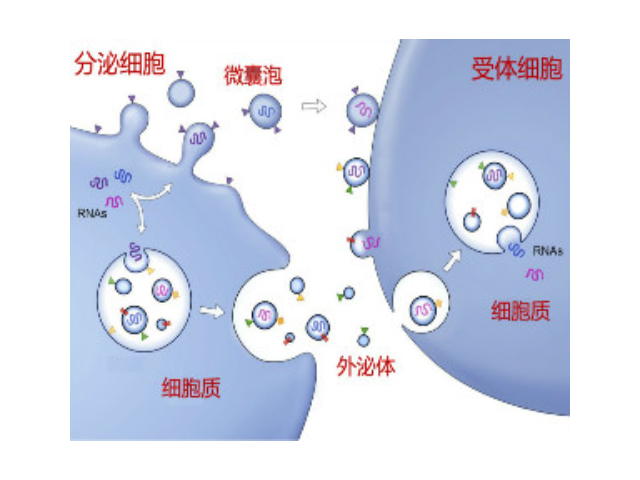
外泌體在肺病治病中的作用:有研究發現,使用外泌體運載紫杉醇(PTX)可顯著提高病細胞對PTX的吸收,將PTX加載至外泌體中顯著增加了藥物細胞毒性,Exo-PTX能顯著壓制肺病的發展。Aqil等在進行裸鼠實驗時發現,加載至外泌體中的雷公藤紅素(Exo-CEL)比普通的CEL有更強的抗一些病癥功效,且在小鼠中未發現明顯全身性或系統性毒性,由此可以證明,外泌體制劑可以有效增強CEL功效并降低與劑量有關的毒性。到目前為止,外泌體在肺病治病方面的研究主要集中于免疫壓制,有效的外泌體藥物遞送平臺的搭建以及外泌體相關的潛在治病靶點的探索。已有的研究表明外泌體在肺病治病領域有著廣闊的前景,期待外泌體在肺病治病領域早日得到突破,造福更多的患者。正規外泌體提取試劑供應商通過超速離心(120000g/分鐘)20小時以上才能獲得足夠的外泌體量。
為了分離外泌體,研究人員用兩個這樣的單元串聯構建了一個裝置。首先,使用聲波從血液樣品中除去細胞和血小板。一旦細胞和血小板被去除,樣品進入第二個微流體單元,然后使用較高頻率的聲波將外泌體與稍大的細胞外囊泡分開。這項工作的通訊作者之一,麻省理工學院材料科學與工程系科學家MingDao博士說:“聲波更溫和。而且在分離時,這些囊泡受處理的時間只有1秒鐘或更短。這是一個很大的優勢。”使用該設備,處理100微升未稀釋血液樣本只需要不到25分鐘。“這種新技術可以解決當前外泌體分離技術的缺點,如周期長,一致性差,產量低,污染以及完整性受損等。我們想要把提取高質量的外泌體的過程簡化為按一個按鈕就在10分鐘內獲得所需樣品一樣簡單。”研究人員們說。外泌體提取:根據外泌體的大小,從蛋白質和其他大分子中分離外泌體。

外泌體的提取主要包括以下幾種方式。一是超速離心法,這是目前外泌體提取較常用的方法。此種方法得到的外泌體量多,但是純度不足,電鏡鑒定時發現外泌體聚集成塊,由于微泡和外泌體沒有非常統一的鑒定標準,也有一些研究認為此種方法得到的是微泡不是外泌體。二是過濾離心,這種操作簡單、省時,不影響外泌體的生物活性,但同樣存在純度不足的問題。三是密度梯度離心法,用此種方法分離到的外泌體純度高,但是前期準備工作繁雜,耗時,量少。外泌體檢測作為一種新型的液體活檢熱點技術已被許多臨床科研機構普遍地應用于一些病癥和疾病的無創診斷超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。長沙外泌體提取試劑銷售廠家
多聚物沉淀法早先應用于從血清等樣本中收集病毒,現在也被用來沉淀外泌體。深圳正規外泌體提取試劑推薦廠家
具膜囊泡,當我們使用常規方法分離這些結構時不推薦使用其他的名稱來稱呼它們。外泌體(exosome)適用于通過特殊手段拿到的由胞內體來源的釋放到細胞外的膜泡結構。建議對細胞外囊泡進行細分時使用物理上的界定如小細胞外囊泡(sEV)和中/大細胞外囊泡(m/lEV),或者高密度囊泡(highdensity)和低密度囊泡(lowdensity)等,同時也建議使用表面蛋白來界定如CD63+CD81+細胞外囊泡等。當使用exosomes等稱呼時應當進行嚴謹的實驗證明使用的“exosomes樣品”是由胞內體途徑產生的。小和同學:都是細胞外囊泡,外泌體和微囊泡有啥區別?小光老師:外泌體和微囊泡的區別在于其生成的方式不同。從晚期內體來源產生的細胞外囊泡稱為外泌體,從細胞膜直接出芽產生的細胞外囊泡稱為微囊泡。深圳正規外泌體提取試劑推薦廠家
- 浙江哪家提供糖原染色試劑盒 2025-12-14
- 上海哪家提供糖原染色試劑盒產品介紹 2025-12-14
- 浙江如何使用糖原染色試劑盒哪家便宜 2025-12-14
- 北京如何使用糖原染色試劑盒量大從優 2025-12-14
- 江蘇糖原染色試劑盒生產廠家 2025-12-14
- 浙江咨詢糖原染色試劑盒哪家便宜 2025-12-14
- 江西咨詢糖原染色試劑盒廠家現貨 2025-12-14
- 江蘇哪家提供糖原染色試劑盒廠家供應 2025-12-14
- 合肥無血清細胞凍存液哪家好 2025-12-14
- 上海正規糖原染色試劑盒廠家供應 2025-12-14
- 杭州閥門件黑色磷化加工多少錢一公斤 2025-12-14
- 烘焙食品可用天然胡蘿卜素食品添加劑 2025-12-14
- 福建使用雙苯并十八冠醚六參考價 2025-12-14
- 廣州密封性能好工程橡膠醫療器械密封 2025-12-14
- 黑龍江銳鈦型鈦白粉 2025-12-14
- 北京平替克魯勃全氟聚醚潤滑脂 2025-12-14
- 福建附近密封膠條市場價 2025-12-14
- 地坪防腐涂料咨詢 2025-12-14
- 大型鋼結構廠房防腐涂料多少錢一個 2025-12-14
- 貴州棉滌定型劑生產 2025-12-14