閔行區(qū)賦悅科技eCTD推薦
美國eCTD驗證采用三級分類:“錯誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護屬于“錯誤”,而書簽路徑非相對性則可能列為“警告”。驗證失敗將直接導致退審,企業(yè)需通過LORENZ Validator等工具預檢,確保提交前合規(guī)。 技術(shù)驗證點 驗證涵蓋XML結(jié)構(gòu)合規(guī)性、文件命名規(guī)則、生命周期管理(如序列號連續(xù)性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗數(shù)據(jù)需額外滿足CDISC標準,包括SDTM和ADaM數(shù)據(jù)集的結(jié)構(gòu)驗證美國IND注冊申報相關(guān)技術(shù)支持。閔行區(qū)賦悅科技eCTD推薦
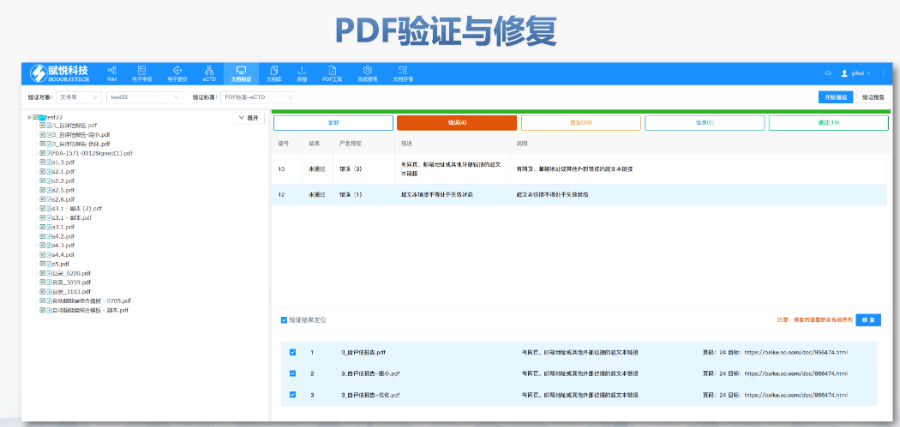
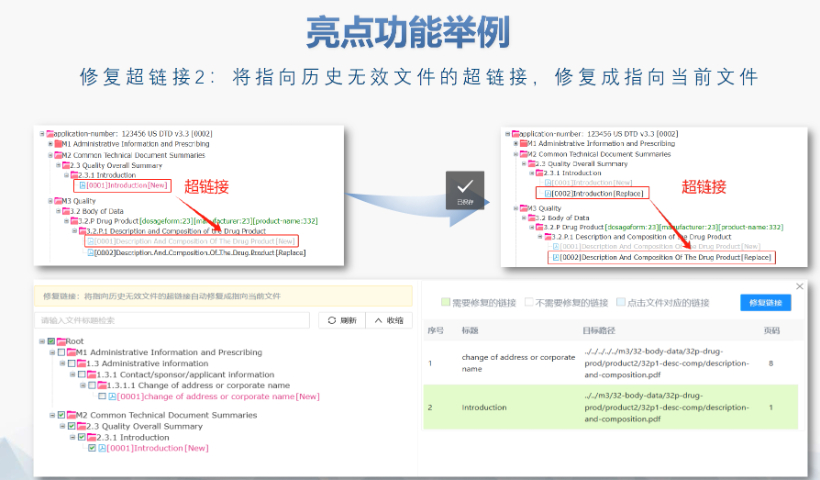
PDF工具箱批量處理與格式修復支持PDF合并、拆分、提取頁面、旋轉(zhuǎn)頁面等操作,可批量修復字體未嵌入、超鏈接錯誤等問題,確保文件符合注冊法規(guī)要求。智能書簽與超鏈接管理提供書簽導入/導出、超鏈接自動生成(支持關(guān)鍵字搜索鏈接)、題注超鏈接拖拽式編輯等功能,簡化復雜文檔的導航設計。文檔轉(zhuǎn)換與OCR識別支持Word轉(zhuǎn)PDF(自動生成書簽、嵌入字體),以及PDF與Word、Excel等格式互轉(zhuǎn),集成OCR功能用于掃描件文字識別。合規(guī)性驗證自動驗證PDF的頁面布局、頁碼連續(xù)性、空白頁、目錄層級等屬性,并具體錯誤位置,減少人工檢查成本。安全與協(xié)作功能支持文檔加密、數(shù)字簽名、云端同步及多設備共享,滿足企業(yè)級文件安全管理需求。徐匯區(qū)ANDAeCTD服務介紹加拿大NDA注冊申報相關(guān)技術(shù)支持。
爭議解決與法律救濟若申請人對審評結(jié)果有異議,可向EMA的CHMP申請重審查,或在歐盟法院提起行政訴訟。eCTD的完整提交記錄可作為法律證據(jù),證明申請人已履行合規(guī)義務。EDQM設立仲裁wei員會,處理CEP程序中的技術(shù)爭議。行業(yè)趨勢與競爭格局全球eCTD服務市場年增長率達12%,歐盟占據(jù)35%份額,主要服務商包括PharmaLex、Certara等。頭部yao企通過自建IT團隊降低成本,而中小型企業(yè)依賴外包以專注研發(fā)。人工智能(AI)在文件自動生成和審評意見預測中的應用逐漸增多。患者參與與透明度提升EMA通過公開eCTD摘要(如模塊)增強審評透明度,患者可提交意見影響審評決策。部分成員國要求模塊1包含患者語言版本說明書,以提升用yao依從性。未來,,實現(xiàn)全生命周期互動。
多國審評程序與eCTD遞交途徑的適配:歐盟yao品審評程序包括集中(CP)、分散(DCP)、互認(MRP)和guo家程序(NP),eCTD需適配不同程序的遞交要求。例如:集中審評程序(CP):通過EMA的eSubmissionGateway提交,審評時限約240個工作日,eCTD需包含完整的模塊1-5及多語言標簽文件。分散審評程序(DCP):需通過CESP(歐盟共同提交門戶)遞交,參考成員國(RMS)主導審評,eCTD需支持多國同步評估的模塊化拆分。互認程序(MRP):已授權(quán)成員國作為RMS,eCTD需包含基線序列(BaselineSequence0000)以整合歷史審評數(shù)據(jù),并通過CMDh協(xié)調(diào)分歧。瑞士eCTD注冊咨詢相關(guān)技術(shù)支持。

美國于2003年成為全球早采用eCTD(電子通用技術(shù)文檔)的國家之一,初由CDER和CBER作為電子提交平臺試點。2008年起,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標準格式,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位。至2017年,F(xiàn)DA強制要求所有藥申請(NDA)、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,標志著其從可選到強制的轉(zhuǎn)型。這一進程在2018年擴展至臨床試驗申請(IND),終實現(xiàn)全類型藥品注冊的電子化覆蓋。歐盟eCTD注冊外包相關(guān)技術(shù)支持。徐匯區(qū)國內(nèi)注冊eCTD報價
美國ESG電子提交通道申請相關(guān)技術(shù)支持。閔行區(qū)賦悅科技eCTD推薦
美國電子提交通道ESG(ElectronicSubmissionsGateway)是美國食品yao品監(jiān)督管理局(FDA)建立的電子化監(jiān)管信息提交系統(tǒng),旨在為制yao、生wu制品、醫(yī)療器械等行業(yè)提供安全、gao效的電子申報服務。自2006年啟用以來,ESG已成為FDA接收電子監(jiān)管材料的入口,每日處理上千份提交文件,涵蓋上市前審批、上市后監(jiān)管、臨床試驗數(shù)據(jù)、不良反應報告等多種類型。該系統(tǒng)通過數(shù)字證shu加密和公鑰基礎設施(PKI)技術(shù),確保文件傳輸?shù)恼鎸嵭浴⑼暾院筒豢煞裾J性,符合FDA對電子提交的嚴格合規(guī)要求。在技術(shù)層面,ESG具備強大的文件處理能力。2018年系統(tǒng)升級后,取消了單個文件8GB的限制,可支持高達35GB的大型文件提交,進一步滿足復雜申報需求。此外,文件格式需遵循eCTD(電子通用技術(shù)文檔)規(guī)范,包括模塊化結(jié)構(gòu)、PDF標準化和XML元數(shù)據(jù)整合,以確保全球監(jiān)管機構(gòu)兼容性。2025年3月28日起,F(xiàn)DA將啟用新一代平臺ESGNextGen,逐步替代現(xiàn)有系統(tǒng),過渡期需關(guān)注兼容性和穩(wěn)定性問題。閔行區(qū)賦悅科技eCTD推薦
- 楊浦區(qū)eCTD品牌 2025-12-20
- 河北仿制藥eCTD 2025-12-20
- 合肥NDAeCTD品牌 2025-12-20
- 吉林國際注冊eCTD 2025-12-20
- 無錫賦悅科技eCTD找哪家 2025-12-20
- 楊浦區(qū)國際注冊eCTD醫(yī)療科技 2025-12-20
- 徐匯區(qū)中國eCTD報價 2025-12-20
- 蘇州新藥eCTD 2025-12-20
- 北京加拿大eCTD 2025-12-20
- 靜安區(qū)CDE eCTD品牌 2025-12-20