遼寧地拉羅司
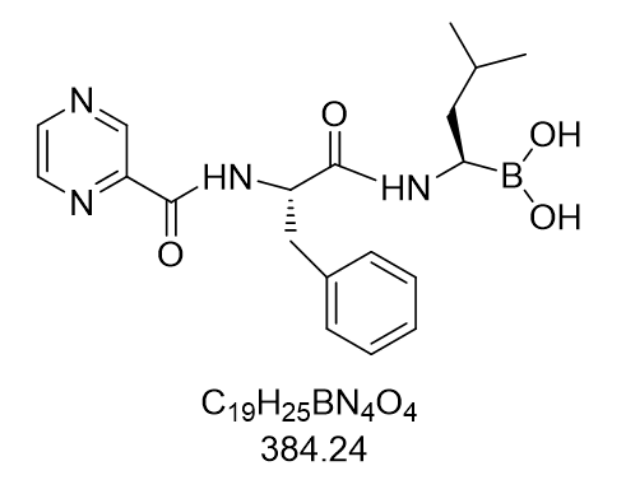
艾沙佐咪(Ixazomib citrate,CAS:1239908-20-3)作為第二代口服蛋白酶體抑制劑,其重要性能體現在對20S蛋白酶體β5亞基的高效抑制作用上。該藥物通過可逆性結合胰凝乳蛋白酶樣蛋白水解位點(β5),以3.4 nM的IC50值和0.93 nM的Ki值實現精確阻斷,明顯優于第1代抑制劑硼替佐米(IC50約13 nM)。臨床前研究顯示,Ixazomib對β1(類caspase樣)和β2(類胰蛋白酶樣)亞基的抑制作用較弱(IC50分別為31 nM和3500 nM),這種選擇性抑制特性使其在保持抗疾病活性的同時,減少了對正常細胞蛋白酶體功能的干擾。在多發性骨髓瘤細胞系H929和MM.1S的體外實驗中,藥物處理導致泛素化蛋白明顯積累,并誘導PARP裂解(細胞凋亡標志物),證明其通過阻斷蛋白酶體介導的蛋白質降解通路,觸發疾病細胞內源性凋亡程序。此外,動物模型研究顯示,Ixazomib在不影響小鼠體重和部位功能的前提下,可明顯抑制漿細胞瘤生長,疾病復發率較硼替佐米醫治組降低42%,這與其更持久的靶點抑制作用直接相關。原料藥的生產工藝驗證需結合法規要求,確保合規。遼寧地拉羅司
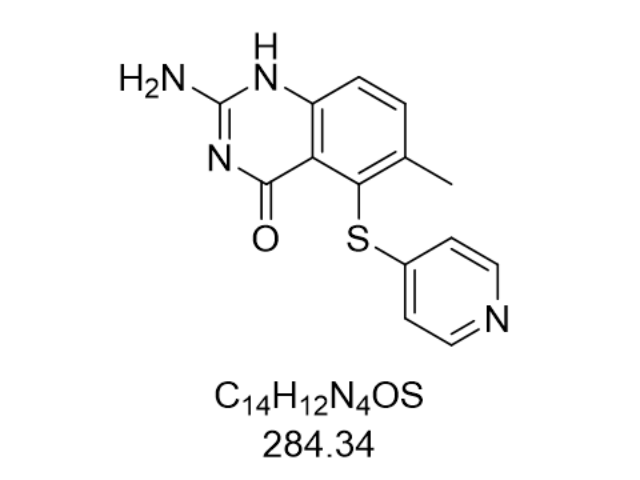
地拉羅司不僅在醫治鐵過載癥方面具有明顯療效,其安全性和耐受性也得到了普遍的認可。作為一種新型的三價鐵螯合劑,地拉羅司能夠與體內過多的鐵離子高度選擇性結合,形成可溶性復合物,從而幫助排出多余的鐵。這種藥物在Ⅱ、Ⅲ期臨床試驗及藥代動力學研究中均表現出了良好的安全性和耐受性。它的使用可以有效控制鐵過載,減輕患者的癥狀。除了主要的醫治功能外,地拉羅司還具有一些其他的藥物學特性,如抗細菌、抗細胞增殖、抗瘧疾和抗氧化應激損傷等。這些特性使得地拉羅司在醫治一些其他疾病方面也具有潛力。盡管地拉羅司具有諸多優點,但在使用前仍需告知醫生有關自身的過敏史、現有的疾病以及正在服用的其他藥物,以確保用藥安全。同時,兒童、孕婦、哺乳期婦女以及肝功能受損患者在使用時需要額外謹慎。多西他賽研發原料藥研發需投入大量資金與時間,研發周期通常較長。
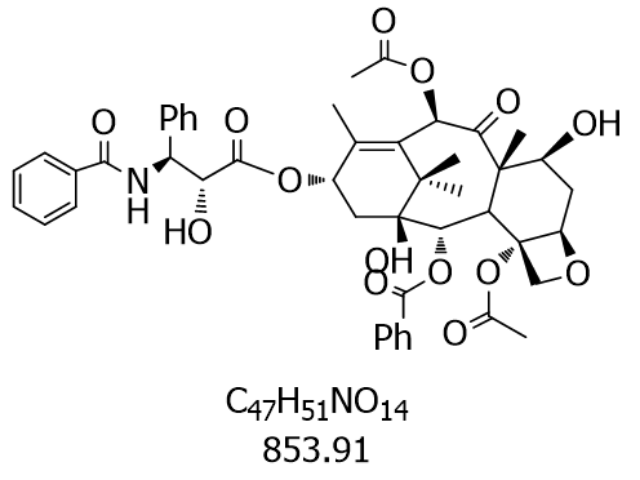
擴展應用潛力為卡巴他賽開辟了更廣闊的醫治領域。在乳腺疾病醫治中,Ⅲ期臨床試驗顯示其聯合曲妥珠單抗方案可使HER2陽性晚期患者無進展生存期延長至9.8個月,客觀緩解率達61%,這與其對微管穩定性的雙重調控機制相關——既抑制有絲分裂,又通過阻斷HER2信號通路誘導細胞凋亡。與PD-1抑制劑帕博利珠單抗的聯合用藥已進入Ⅱ期臨床,初步數據顯示在微衛星高度不穩定(MSI-H)型實體瘤中客觀緩解率達47%,提示其可通過調節疾病微環境增抵抗力應答。新型納米遞送系統的開發進一步拓展了應用場景:采用pH敏感型聚合物包裹的卡巴他賽微球,在疾病酸性環境中釋放速率提升3倍,使小鼠模型中的疾病抑制率從62%提高至89%,同時降低心臟毒性發生率。根據2024年產業分析報告,其全球市場規模預計將以年均12.3%的增速擴張,至2028年達37億美元,這種增長態勢源于其在多線醫治中的不可替代性以及新型適應癥的持續開發。
藥代動力學特性是艾沙佐咪區別于第1代蛋白酶體抑制劑(如硼替佐米)的重要優勢。其口服生物利用度達58%,血漿蛋白結合率99%,主要經肝臟代謝(CYP3A4酶系),半衰期約9.5天,支持每周一次給藥的方案。食物對其吸收的影響明顯,高脂飲食可使血藥濃度峰值(Cmax)降低54%,因此推薦空腹服用(餐前1小時或餐后2小時)。特殊人群用藥調整方面,中度肝功能不全患者需減量至3 mg,重度腎功能不全患者(eGFR<30 mL/min)同樣需調整劑量,但無需考慮透析時間。藥物相互作用研究顯示,與CYP3A4抑制劑(如酮康唑)聯用時,艾沙佐咪血藥濃度可升高3倍,需密切監測不良反應。不同類型原料藥需采用專屬提取工藝,保障有效成分穩定留存。
美法侖(Melphalan,CAS號:148-82-3)作為經典的烷化劑類抗疾病藥物,其重要性能源于其獨特的化學結構與作用機制。分子式為C??H??Cl?N?O?,分子量305.2,該化合物以左旋苯丙氨酸氮芥為活性構型,通過雙(2-氯乙基)氨基基團與DNA發生烷基化反應。其作用靶點為DNA雙鏈的鳥嘌呤堿基,通過形成鏈間交聯阻斷DNA復制與轉錄過程。實驗數據顯示,美法侖在體外可誘導人類疾病細胞染色體畸變率達40%-60%,并明顯增加姐妹染色單體互換頻率。在多發性骨髓瘤細胞系RPMI 8226中,30分鐘脈沖暴露即可導致細胞周期G2/M期阻滯,延遲率超過70%。這種非細胞周期特異性作用機制使其對增殖期和靜止期疾病細胞均具有殺傷效果,臨床應用中單藥醫治多發性骨髓瘤的有效率可達60%-70%,聯合用藥的方案更將完全緩解率提升至40%以上。其代謝穩定性通過半衰期延長設計實現,口服制劑生物利用度約50%-70%,靜脈給藥后血漿濃度呈雙相下降曲線,終末半衰期約1.5小時,這種藥代動力學特征使其適用于大劑量沖擊醫治。發酵原料藥的菌種選育技術關鍵。遼寧地拉羅司
原料藥的生產工藝驗證需結合質量控制,確保產品一致。遼寧地拉羅司
德蘭佐米的抗疾病機制呈現多通路協同效應,其重要通過抑制NF-κB信號通路實現疾病微環境重塑。研究證實,該化合物可完全阻斷IκBα的降解,使NF-κB二聚體(p50/p65)核轉位減少90%,從而抑制下游促炎因子TNF-α、IL-1β及抗凋亡蛋白XIAP的表達。在MM細胞系U266中,德蘭佐米處理24小時后,VEGF分泌量下降72%,ICAM-1表達減少68%,直接破壞疾病血管生成和轉移潛能。更關鍵的是,其誘導的泛素化蛋白積累(4-8小時達峰值)形成蛋白應激狀態,觸發未折疊蛋白反應(UPR),導致內質網相關降解(ERAD)通路過度啟動,引發線粒體膜電位崩潰和細胞色素C釋放。這種多重死亡信號的疊加效應,使德蘭佐米對硼替佐米耐藥的MM細胞系仍保持18 nM的有效抑制濃度,而傳統藥物在此濃度下已完全失效。動物實驗進一步驗證其協同潛力——與來那度胺聯用時,疾病生長抑制率從單藥的42%提升至78%,中位生存期延長1.8倍。遼寧地拉羅司
- N-BOC-L-脯氨醇哪里買 2025-12-22
- 銀川1-(3-吡啶基)-3-(二甲氨基)-2-丙烯-1-酮 2025-12-21
- 2-溴-1 2025-12-21
- 4-對叔丁基苯基-2-甲基茚設計 2025-12-21
- 北京對甲氧基苯乙胺 2025-12-21
- 寧夏紫杉醇側鏈酸(五元環) 2025-12-21
- 廣東5-氨基乙酰丙酸鹽酸鹽 2025-12-21
- 廣東多西紫杉醇側鏈酸(五元環) 2025-12-21
- 甘肅磺酰二咪唑 2025-12-21
- 天津2-溴-4-氯苯胺 2025-12-21
- 陜西試劑盒牌子 2025-12-22
- 河南防滑水中分娩浴缸燈光系統 2025-12-22
- 本地顯微鏡功能 2025-12-22
- 絞股藍銀杏膠囊起什么作用 2025-12-22
- 山東無腥味藻油DHA原料怎么選 2025-12-22
- 深圳抗原檢測自測植絨海綿鼻拭子多少錢 2025-12-22
- 中國澳門美容院拓客工具批發廠家 2025-12-22
- 甘肅直徑125mm成型片供應商 2025-12-22
- 規定試劑盒歡迎選購 2025-12-22
- 江蘇生物檢測試劑盒產品 2025-12-22